表面,确切地说是指物体相对真空或本身的蒸气所接触的界面。而物体与另一物体相接触的表面,应称之为界面,即两种相的交界面。人们所研究的表面现象,都是发生在界面上的现象,由于习惯,仍称之为表面。
表面张力:液体表面上的分子不同于液体内部的分子,液体内部的分子受周围分子对它的吸引而平衡,而液体表面上的分子所受液体内部分子的吸引力大于受液体表面以外空气分子的吸引力,从而使液体表面具有自动缩小的趋势。当内部分子上升到液体表面上组成新液体表面时,就必须克服内部分子的引力而做功,如同举起重物做功一样,从而使处于液体表面上的液体分子的能量增加,产生使液体表面缩小的力,这个力就叫做表面张力。
表面能:固体表面的质点(分子、原子、离子)也和液体表面上的质点一样,处于力场的不平衡状态中,这些力场不会突然消失,而继续延伸到固体以外的空间,使表面具有一定的能量。
当两个物体彼此靠近而进入接触时,两物体便被其表面的凸峰所分开,两物体的表面越光洁,接近的程度就越高,可见表面粗糙度值小的物体,表面能大。如果把两个表面粗糙度值很小的物体压在一起,靠界面上分子间的吸引力,就会形成非常牢固的粘结;同时,表面能高的表面会导致快速的表面吸附,吸附层使表面隔开,从而减少了摩擦。
表面上的大多数质点都表现出很高的化学活性,急于吸引其邻近质点即外来的分子、原子、离子,而得到某种补偿,结果就降低了固体的表面能(自由焓)。金属表面形成的氧化膜降低了金属的表面能。同样,对表面进行润滑的结果,就是明显减弱了物体的表面能。固体表面能的概念已经成为研究摩擦磨损问题中公认的主题,但是至今还没有更多的资料作为定量分析的基础。
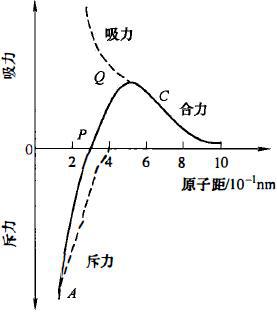
固体表面的分子、原子、离子吸附周围邻近粒子这一现象,说明固体表面具有表面力,表面力是在很小的距离上才发生作用的(图1)。对于两个铜原子来说,当两个原子的距离为0.3nm(相当于铜原子的直径)时,在P点上,吸力和斥力相平衡;OP为其平衡原子距。对于所有原子、分子间的作用都具有图1-4所示的形式,Q点是使两个原子分离的临界点。物体的表面力是指两相或两物体相互作用时有助于物体内聚的各种力,按照固体晶体结构的不同,这些力可以是离子键力、共价键力、金属键力和范德华力等。
1、离子键力
离子晶体的结合力叫做离子键力。当电离能较小的金属原子与电子亲和能较大的非金属元素的原子相互接近时,前者放出最外层电子而形成正离子,后者吸收前者放出的电子而变成满壳层的负离子,正负离子由于库仑引力作用而相互靠近,当它们靠近到一定程度时,两闭合壳层的电子云因重叠而产生排斥力,当斥力和吸力相等时就可以形成稳定的离子键。离子键没有方向性和饱和性。氯化钠晶体就是典型的离子晶体。
2、共价键力
原子晶体的结合力称为共价键力,原子晶体又称为共价晶体,典型的是氢分子(H2)中的两个原子之间的结合。两个氢原子相互靠近形成分子时,两个价电子集中在两原子核之间运动,为两原子核所共有,且两电子的自旋相反,故共价键是由两原子之间一对自旋相反的共有电子形成的。共价键的结合力很强,具有方向性和饱和性。具有代表性的共价晶体是金刚石。
3、金属键力
在金属晶体中,原子失去了它的部分或全部价电子而成为离子实,这些离开原子的价电子,不属于某一个离子实所专有,而为全体离子实所共有,金属键力就是靠共有价电子和离子实之间的相互作用而形成的。金属键没有饱和性和明显的方向性,因此金属的结合很牢固,有很高的硬度和熔点,导电和导热性能都很好。
4、范德华力
分子之间的相互作用力称为范德华(VanderWaals)力。分子晶体的结构单元就是分子,分子晶体的结合力就是范德华力,故称为范德华键,这种键没有方向性和饱和性。由于相互极化而产生的引力很弱,晶体结合力很小,熔点和硬度都很低。范德华键就是靠偶极矩或瞬时偶极矩的相互作用、相互极化而产生吸引力的。表1-1给出上述四种力的主要特性。
| 表面力类别 | 离子键力 | 共价键力 | 金属键力 | 范德华力 |
| 化学键 | 离子键 | 共价键 | 金属键 | 范德华键 |
| 作用方式 | 静电场 | 电子分布交错 | 界面游离电子 | 电磁场振动 |
| 作用范围 | <原子尺寸 | =原子尺寸 | ≈原子尺寸 | 原子尺寸 |
| 结合能/eV | 8.5 | 6.0 | 2.5 | 0.1 |